さて、前回に引き続き、法律について学んでいきましょう
ここの範囲はそのまま覚えてしまうというのが早いですが、一度ではなかなか理解もしにくいと思いますので何度も繰り返し復習していきましょう
毒薬・劇薬について
医薬品には普通薬、劇薬、毒薬といった分類をすることができます
この分類はどういった基準で分けられているのかをここでしっかり覚えていきましょう
ちなみに、毒物・劇物とはまた違いますのでその点も区別して理解できるようにしましょう(これは「毒物及び劇物取締法」で定められています)
毒薬・劇薬とは
薬効が期待される摂取量の薬用量と、中毒のおそれがある摂取量である中毒量が近く、安全域が狭いものが取り扱いに注意が必要とされています
この安全域が狭くなっていくほど普通薬、劇薬、毒薬と区別されます
これは経口投与する時の致死量の程度で決められています
その区別が外箱の表示からも見て取れるように医薬品名の表記方法が決まっています(これは毒物・劇物に対してもあります)
<毒薬・劇薬の定義>
劇薬:致死量が体重1kgあたり300mg以下のもの
(皮下注射では200mg/kg以下、静脈注射では100mg/kg以下)
毒薬:致死量が体重1kgあたり30mg以下のもの
(皮下注射では20mg/kg以下、静脈注射では10mg/kg以下)
つまり、毒薬は劇薬よりも10倍も範囲が狭いことがわかりますね
(つまり、より少ない量で死に至るということ)

毒薬・劇薬、毒物・劇物の表示、表記方法について
毒薬、劇薬、毒物、劇物の違いがわかったところで、実際に視覚的にどういった区別がされているかも確認していきましょう
試験的には、実際に絵を描いてみて、それから文字に変換して問題を解くと良いでしょう
毒薬:黒地に白枠で医薬品名を囲い、医薬品名は白字で表記される
劇薬:白地に赤枠で医薬品名を囲い、医薬品名は赤字で表記される
毒物:容器に「医療用外」の文字及び赤地に白字で「毒物」と表記される
劇物:容器に「医療用外」の文字及び白地に赤字で「劇物」と表記される





毒薬・劇薬の交付の禁止について
毒薬または劇薬は、14歳未満の者その他安全な取り扱いに不安のある者への交付は禁止となっている
毒薬・劇薬を販売・譲渡する際について
毒薬または劇薬を販売または譲渡をする際、その医薬品を譲り受ける者から決められた内容が記載された文書の交付を受けなければならないとされている
その文書に記載されなければならない内容とは
| 品名 |
| 数量 |
| 使用目的 |
| 譲渡年月日 |
| 譲渡人の氏名 |
| 譲受人の住所 |
| 譲受人の職業 |
| 譲受人の署名又は記名押印 |
これは、一定の条件を満たした電子的ファイルへの記録によるものでも可とされている
毒薬・劇薬の分割販売について
店舗管理者が薬剤師である店舗販売行者及び営業所管理者が薬剤師である卸売販売行者以外の医薬品の卸売業者は、開封して販売等してはならない、とされている
→薬剤師が関わっていないと、分割販売はできないということになる
生物由来製品について
人その他の生物(植物を除く)に由来するものを原料又は材料として製造される医薬品、医薬部外品、化粧品又は医療機器のうち、保険衛生上特別の注意を要するものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するもの。
この他に、「特定生物由来製品」という分類もあるが、ここでは割愛させていただきます
生物由来製品については、製品における感染症の発生リスクがあり、以下のような特徴があります
(1)病原性の細菌、ウイルスを原料とし、一定の不活化、弱毒化等の措置が講じられているもの
(2)人又は動物の管理された細胞株又は管理された動物個体(遺伝子組み換え含む)により生産されるタンパク等を用い、一定のウイルス等病原体の存在の否定についての確認、不活化除去が行われているもの
(3)健康の確認された不特定多数の動物から得られた原料を用いたものであり、一定の病原体の不活化、除去等が行われているもの
例:(1)ワクチン、抗毒素など (2)遺伝子組み換えタンパク、培養細胞由来のタンパクなど (3)ヘパリンなどの動物抽出成分など
一般用医薬品のリスク区分について
この内容は適宜内容の見直しがされています
| 区分 | 内容 |
|---|---|
| 第一類医薬品 | その副作用等により日常生活に支障を来す程度の健康被害が生ずるおそれがある医薬品であって、その使用に関し特に注意が必要なものとして厚生労働大臣が指定するもの 新一般用医薬品として承認を受けてから厚生労働省令で定める期間を経過しないもの (一般用医薬品としての使用経験が少ない等安全性上特に注意を要する成分を含むもの) |
| 第二類医薬品 | その副作用等により日常生活に支障を来す程度の健康被害が生ずるおそれがある医薬品であって、その使用に関し特に注意が必要なものとして厚生労働大臣が指定するもの(第一類医薬品を除く) (まれに入院相当以上の健康被害が生じる可能性がある成分を含むもの) |
| 指定第二類医薬品 | 第二類医薬品のうち、特別の注意を要するものとして厚生労働大臣が指定するもの (情報を提供するための設備から7m以内の範囲に陳列するなどの措置をとる) |
| 第三類医薬品 | 第一類及び第二類医薬品以外の一般用医薬品 (日常生活に支障を来す程度ではないが、身体の変調・不調がおこるおそれがあるもの) |
<参考>
厚生労働省:一般用医薬品のリスク区分
https://www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000050568.pdf(閲覧:2022.9.10)
一般用医薬品の容器、外箱等に記載されていなければならない法定表示事項について
法定表示事項というのは、見やすい場所に、明瞭に、邦文で記載されなければならないとされています
また、医薬品の容器等が包装され、透かして容易に見ることができない場合、外箱等にも法定表示事項が記載されていなければならないとされています
| 製造販売行者等の氏名又は名称及び住所 |
| 名称 (日局に収載されている医薬品では日局において定められた名称、また、その他の医薬品で一般的名称があるものではその一般的名称) |
| 製造番号又は製造記号 |
| 重量、容量又は個数等の内容量 |
| 日局に収載されている医薬品については「日本薬局方」の文字等 |
| 要指導医薬品である旨を示す識別表示 |
| 一般用医薬品のリスク区分を示す識別表示 |
| 日局に収載されている医薬品以外の医薬品における有効成分の名称及びその分量 |
| 謝って人体に散布、噴霧等された場合に健康被害を生じるおそれがあるものとして厚生労働大臣が指定する医薬品(殺虫剤等)における「注意-人体に使用しないこと」の文字 |
| 適切な保存条件の下で、3年を超えて性状及び品質が安定でない医薬品等、厚生労働大臣の指定する医薬品における使用の期限 |
| 配置販売品目以外の一般用医薬品にあっては、「店舗専用」の文字 |
| 指定第二類医薬品にあっては、枠の中に「2」の数字 |
医薬部外品と化粧品について
それぞれの定義について比較して確認していきましょう
<医薬部外品とは>
(1)内容
①吐き気その他の不快感又は口臭若しくは体臭の防止、あせも、ただれ等の防止、脱毛の防止、育毛又は除毛
②衛生害虫の防除のために使用されるもの
③医薬品から医薬部外品に移行されたもの(健胃消化薬、瀉下薬、ビタミン含有保健薬など)
(2)直接の容器又は被包への表示事項
それぞれ(1)①〜③の表示事項は
①「医薬部外品」
②「防除用医薬部外品」
③「指定医薬部外品」
(3)医薬品的な効能効果の表示・標榜
その効能効果があらかじめ定められた範囲内であって、成分や用法等に照らして人体に対する作用が緩和であることを要件として認められる
(4)製造販売
製造販売業の許可が必要であり、品目ごとに承認を得る必要がある
(厚生労働大臣が基準を定めて指定するものを除く)
(5)販売(小売業)
医薬品のような販売業の許可は必要なく、一般小売店で販売できる
<化粧品とは>
(1)内容
人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛髪を健やかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目的とされている物で、人体に対する作用が緩和なもの
(2)直接の容器又は被包への表示事項
なし
(3)医薬品的な効能効果の表示・標榜
一切認められていない
(医薬品が化粧品的な効能効果を表示・標榜することも、不適正な使用を助長するおそれがあり、承認された効能効果に含まれる場合を除き、適当ではない)
(4)製造販売
製造販売業の許可を受けた者が、あらかじめ品目ごとの届出を行う必要がある。厚生労働大臣が指定する成分を含有する化粧品の場合は、品目ごとの承認を得る必要がある
(5)販売(小売業)
医薬品のような販売業の許可は必要なく、一般小売店で販売できる
食品とは
医薬品や医薬部外品及び再生医療等製品以外のすべての飲食物を食品という
これが、原材料である成分本質が医薬品として使用されているものであったり、効能効果が標榜又は暗示されているもの、剤形として医薬品的な形状であること、用法用量の記載があることは、無承認無許可医薬品にあたるとして取り締まられることとなる
(ただし、剤形については食品である旨の明記がある場合に限り、その形状のみをもって医薬品への該当性の判断がなされることはない、とされている)
保健機能食品等の定義について
保健機能食品とは、特定保健用食品(特保)、栄養機能食品、機能性表示食品を総称していいます
| 分類 | 内容 |
|---|---|
| 特別用途食品 | 乳児の発育や妊産婦、授乳婦、嚥下困難者、病者などの健康の保持・回復などに適するという特別の用途について表示を行うもの 内閣総理大臣の許可又は承認を受けたもので、消費者庁の許可等のマークが付されている |
| 特定保健用食品 | 食生活において特定の保健の目的で摂取する者に対し、その摂取により当該特定の保健の目的が期待できる旨の表示を行うもの 消費者庁長官の許可を受けなければならない 表示の許可にあたっては、食品ごとに食品の有効性や安全性について国の審査を受ける必要がある |
| 栄養機能食品 | 特定の栄養成分補給のために利用される食品で、栄養成分の機能を表示するものをいう(1日摂取目安量に含まれる栄養成分の量) 対象は一般用加工食品や一般用生鮮食品である 消費者庁長官の個別の審査を受けたものではない旨の表示が義務づけられている |
| 機能性表示食品 | 事業者の責任で、科学的根拠に基づいた機能性を表示し、販売前に安全性や機能性の根拠に関する情報などが消費者庁長官へ届出されたもの 特定の保健の目的が期待できるという食品の機能性を表示することはできるが、消費者庁長官の個別許可を受けたものではない |
| いわゆる「健康食品」 | 法律上の定義はなく、医薬品以外で経口的に摂取される、健康の維持・増進に特別に役立つことをうたって販売されたり、そのような効果を期待して摂取している食品全般を指している |
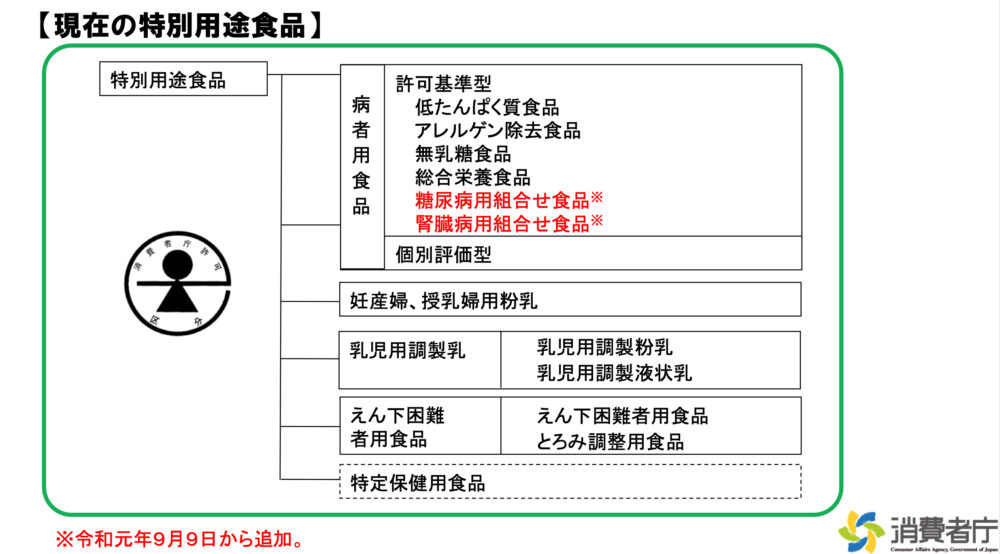

<参考>
日本薬剤師会
「健康食品」について
https://www.nichiyaku.or.jp/activities/health-food/index.html(閲覧:2022.9.10)
厚生労働省
いわゆる「健康食品」とは
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/shokuhin/hokenkinou/index.html(閲覧:2022.9.10)
出典:消費者庁、特別用途食品
https://www.caa.go.jp/policies/policy/food_labeling/health_promotion/pdf/food_labeling_cms206_190909_01.pdf(閲覧:2022.9.10)
出典:消費者庁、特定保健用食品について
https://www.caa.go.jp/policies/policy/food_labeling/health_promotion/pdf/food_labeling_cms206_200602_01.pdf(閲覧:2022.9.10)
今回はここまでとなります
次回で最後となりますので、もう少しです
お疲れ様でした!


